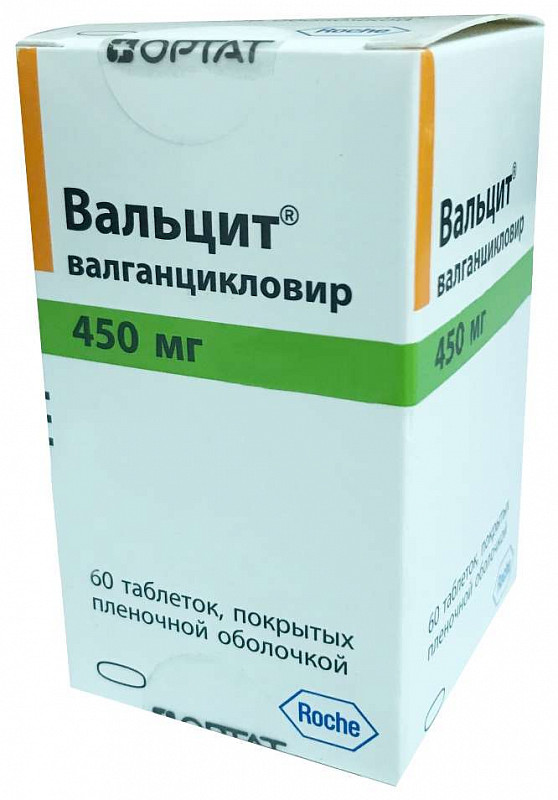
Состав и форма выпуска
Таблетки — 1 таб.:
- Активное вещество: валганцикловира гидрохлорид 496.3 мг, что соответствует содержанию валганцикловира 450 мг.
- Вспомогательные вещества: повидон К30 — 23.9 мг, кросповидон — 23.9 мг, целлюлоза микрокристаллическая — 47.8 мг, стеариновая кислота — 6 мг.
- Состав оболочки: (гипромеллоза 2910 — 3 сП, гипромеллоза 2910 — 6 сП, титана диоксид (Е171), макрогол 400, краситель железа оксид красный (Е172), полисорбат 80) — 18 мг, допускается использование готовой смеси Opadry Pink 15B24005.
60 шт. — флаконы из полиэтилена высокого давления (1) — пачки картонные.
Описание лекарственной формы
Таблетки, покрытые пленочной оболочкой розового цвета, двояковыпуклые, овальной формы, с гравировкой ‘VGC’ на одной стороне и ‘450’ — на другой.
Фармакологическое действие
Валганцикловир представляет собой L-валиловый эфир (пролекарство) ганцикловира, после приема внутрь быстро превращающийся в ганцикловир под действием кишечных и печеночных эстераз. Ганцикловир — синтетический аналог 2′-дезоксигуанозина, который подавляет репликацию вирусов герпес-группы in vitro и in vivo. К вирусам человека, чувствительным к ганцикловиру, относят цитомегаловирус (ЦМВ), вирусы простого герпеса типов 1 и 2, вирус герпеса человека типов 6, 7 и 8, вирус Эпштейна-Барр, вирус ветряной оспы и вирус гепатита В.
В ЦМВ-инфицированных клетках под действием вирусной протеинкиназы UL97 ганцикловир вначале фосфорилируется с образованием ганцикловирмонофосфата. Дальнейшее фосфорилирование происходит под действием клеточных киназ с образованием ганцикловиртрифосфата, который затем подвергается медленному внутриклеточному метаболизму. После исчезновения ганцикловира из внеклеточной жидкости период внутриклеточного полувыведения ганцикловиртрифосфата в клетках, инфицированных ЦМВ, составляет 18 ч, в клетках, инфицированных вирусом простого герпеса — 6-24 ч. Поскольку фосфорилирование ганцикловира в большей степени зависит от действия вирусной киназы, оно происходит преимущественно в инфицированных клетках.
Виростатическая активность ганцикловира обусловлена подавлением синтеза вирусной ДНК посредством следующих механизмов: 1) конкурентное ингибирование встраивания дезоксигуанозинтрифосфата в ДНК под действием вирусной ДНК-полимеразы, 2) включение ганцикловиртрифосфата в вирусную ДНК, что приводит к прекращению удлинения или очень ограниченному удлинению вирусной ДНК. Согласно исследованиям in vitro, типичная ингибирующая концентрация, которая подавляет репликацию ЦМВ на 50% (IC50), находится в диапазоне от 0.08 мкмоль/л (0.02 мкг/мл) до 14 мкмоль/л (3.5 мкг/мл).
Клинический противовирусный эффект препарата Вальцит® был доказан уменьшением выделения ЦМВ из организма больных синдромом приобретенного иммунодефицита (СПИД) и впервые выявленным ЦМВ-ретинитом с исходного показателя 46% до 7% через 4 недели лечения препаратом Вальцит®.
Эффективность
Лечение ЦМВ-ретинита
Клинические исследования были проведены у пациентов со СПИД и ЦМВ-ретинитом. Препарат Вальцит® продемонстрировал одинаковую клиническую эффективность в индукционной терапии ЦМВ-ретинита по сравнению с в/в ганцикловиром.
Применение препарата Вальцит® позволяет получить такое же системное воздействие ганцикловира, как при использовании рекомендованных в/в доз ганцикловира, эффективных при лечении ЦМВ-ретинита. Показано, что AUC ганцикловира коррелирует с промежутком времени до прогрессирования ЦМВ-ретинита.
Профилактика ЦМВ-инфекции
Частота развития ЦМВ-заболевания (ЦМВ-синдром + инвазивная инфекция тканей) в течение первых 6 месяцев после трансплантации сердца, печени, почки у пациентов с высоким риском ЦМВ-инфекции (ЦМВ-позитивный донор (D+)/ЦМВ-негативный реципиент (R-) (D+/R-)) составила 12.1% в группе пациентов, получавших препарат Вальцит® (900 мг/сут), и 15.2% в группе пациентов, получавших ганцикловир внутрь (1000 мг 3 раза/сут) с 10-го по 100-й день после трансплантации. Большая часть случаев пришлась на период после отмены профилактической терапии (после 100-го дня посттрансплантационного периода). При этом случаи развития ЦМВ-инфекции в группе лечения валганцикловиром появлялись позже, чем в группе лечения ганцикловиром. Частота острого отторжения трансплантата в первые 6 месяцев составила 29.7% в группе пациентов, получавших валганцикловир, и 36% в группе пациентов, получавших ганцикловир.
Увеличение продолжительности приема 900 мг препарата Вальцит® до 200-го дня после трансплантации почек у пациентов с высоким риском ЦМВ-инфекции (D+/R-) сопровождалось большей эффективностью предотвращения ЦМВ-инфекции в первые 12 месяцев после трансплантации по сравнению с приемом 900 мг препарата Вальцит® до 100-го дня после трансплантации.
Частота выживаемости трансплантата через 12 месяцев составила 98.1% в группе пациентов, получавших препарат Вальцит® до 100-го дня, и 98.2% в группе пациентов, получавших препарат Вальцит® до 200-го дня. Частота острого отторжения трансплантата, подтвержденного биопсией, в первые 12 месяцев составила 17.2% в группе пациентов, получавших валганцикловир до 100-го дня, и 11.0% в группе пациентов, получавших валганцикловир до 200-го дня.
Вирусная резистентность
При длительном приеме валганцикловира может появиться вирус, устойчивый к ганцикловиру. Это может быть обусловлено либо селекцией мутаций гена вирусной киназы (UL97), отвечающей за монофосфорилирование ганцикловира, либо гена вирусной ДНК-полимеразы (UL54). Вирус, имеющий только мутацию гена UL97, устойчив только к ганцикловиру, в то время как вирус с мутациями гена UL54 может обладать перекрестной резистентностью к другим противовирусным препаратам с аналогичным механизмом действия, и наоборот.
Лечение ЦМВ-ретинита
Генотипирование ЦМВ в полиморфноядерных лейкоцитах показало, что через 3, 6, 12 и 18 месяцев лечения валганцикловиром соответственно в 2.2%, 6.5%, 12.8% и 15.3% лейкоцитов выявляются мутации UL97.
Профилактика ЦМВ-инфекции у пациентов после трансплантации солидных органов
Генотипирование ЦМВ в полиморфноядерных лейкоцитах показало:
1) отсутствие мутаций, обуславливающих резистентность к ганцикловиру, в образцах, полученных на 100-й день (конец профилактического приема валганцикловира) у пациентов из группы валганцикловира, и наличие мутаций в образцах, полученных у пациентов, принимавших ганцикловир перорально (1.9%),
2) отсутствие мутаций, обуславливающих резистентность, в образцах, полученных у пациентов, рандомизированных в группу валганцикловира с подозреваемой ЦМВ-инфекцией через 6 месяцев после трансплантации, и наличие мутаций у пациентов, получавших ганцикловир перорально, в 6.9%.
Доклинические данные по безопасности
Результаты исследований канцерогенности валганцикловира на мышах соответствуют положительным результатам таких же исследований ганцикловира. Как и ганцикловир, валганцикловир является потенциальным канцерогеном.
Валганцикловир и ганцикловир оказывали мутагенное действие в клетках лимфомы мышей и кластогенный эффект в клетках млекопитающих.
Учитывая быстрое и полное преобразование препарата в ганцикловир, дополнительные исследования репродуктивной токсичности с валганцикловиром не проводились. К обоим препаратам относится одно и то же предупреждение о возможной репродуктивной токсичности. У животных ганцикловир нарушает фертильность и оказывает тератогенный эффект. С учетом экспериментов на животных, у которых системное воздействие ганцикловира в концентрациях ниже терапевтических вызывало аспермию, весьма вероятно, что ганцикловир и валганцикловир могут угнетать сперматогенез у человека.
Данные, полученные в модели с использованием плаценты человека ex vivo, показывают, что ганцикловир проникает через плаценту, вероятнее всего, путем простого переноса. В диапазоне концентраций от 1 до 10 мг/мл переход препарата через плаценту носил ненасыщаемый характер и осуществлялся посредством пассивной диффузии.
Фармакокинетика
Фармакокинетические характеристики валганцикловира изучались у ВИЧ- и ЦМВ-сероположительных пациентов, у больных СПИД и ЦМВ-ретинитом и после трансплантации солидных органов.
Параметрами, определяющими экспозицию ганцикловира после приема валганцикловира, являются биодоступность и функция почек. Биодоступность ганцикловира была сходной у всех пациентов, получавших валганцикловир. Системная экспозиция ганцикловира для реципиентов трансплантата сердца, почки, печени была сходной с таковой после перорального приема валганцикловира в соответствии с режимом дозирования в зависимости от функции почек.
Всасывание
Валганцикловир является пролекарством ганцикловира, хорошо всасывается в ЖКТ, в стенке кишечника и в печени быстро метаболизируется с образованием ганцикловира. Абсолютная биодоступность ганцикловира после приема валганцикловира составляет около 60%. Системная экспозиция валганцикловира невысокая и носит кратковременный характер. AUC24 и Сmax в плазме крови составляют примерно 1% и 3% от таковых ганцикловира, соответственно.
Пропорциональная зависимость AUC ганцикловира от дозы после приема валганцикловира в дозах от 450 до 2625 мг показана только для случая приема препарата после еды. Если валганцикловир принимают во время еды в рекомендованной дозе 900 мг, возрастают как средний показатель AUC24 (примерно на 30%), так и средний показатель Сmax (примерно на 14%) ганцикловира. Следовательно, препарат Вальцит® рекомендуется принимать во время еды.
Распределение
Благодаря быстрому метаболизму валганцикловира в ганцикловир, связывание валганцикловира с белками плазмы не определяли. Связывание ганцикловира с белками плазмы при концентрациях препарата от 0.5 до 51 мкг/мл составляет 1-2%. Равновесный Vdганцикловира после в/в введения составил 0.680±0.161 л/кг.
Метаболизм
Валганцикловир быстро гидролизуется с образованием ганцикловира, других метаболитов не выявлено. После однократного приема внутрь 1000 мг меченного радиоактивным изотопом ганцикловира показатель радиоактивности ни одного из метаболитов в кале или моче не превышал 1-2%.
Выведение
Основным путем выведения валганцикловира, как и ганцикловира, является клубочковая фильтрация и активная канальцевая секреция. На почечный клиренс приходится 81.5±22% системного клиренса ганцикловира.
Фармакокинетика в особых клинических случаях
Больные с почечной недостаточностью
Нарушение функции почек приводило к снижению клиренса ганцикловира, образующегося из валганцикловира, с соответствующим увеличением T1/2 в терминальной фазе. Следовательно, больным с нарушением функции почек требуется коррекция дозы.
Больные с печеночной недостаточностью
Фармакокинетику валганцикловира изучали у больных со стабильно функционирующим трансплантатом печени в открытом исследовании c четырехкомпонентным перекрестным дизайном. Абсолютная биодоступность ганцикловира, образующегося из валганцикловира (при однократном приеме препарата в дозе 900 мг после еды), составила примерно 60%, что совпадает с показателем у других групп пациентов. AUC0-24 ганцикловира была сопоставима с таковой после в/в введения ганцикловира в дозе 5 мг/кг больным, перенесшим пересадку печени.
Клиническая фармакология
Противовирусный препарат.
Показания к применению
- Лечение ЦМВ-ретинита у больных СПИД,
- профилактика ЦМВ-инфекции после трансплантации солидных органов у пациентов из группы риска.
Противопоказания к применению
- Абсолютное число нейтрофилов менее 500 клеток в 1 мкл, число тромбоцитов менее 25 000 клеток в 1 мкл или концентрация гемоглобина ниже 80 г/л,
- КК менее 10 мл/мин,
- детский и подростковый возраст до 18 лет,
- повышенная чувствительность к валганцикловиру, ганцикловиру или любому компоненту препарата. Из-за сходного химического строения валганцикловира, ацикловира и валацикловира возможны реакции перекрестной чувствительности к этим препаратам.
С осторожностью следует назначать препарат пациентам пожилого возраста (безопасность и эффективность препарата не установлены).
Применение при беременности и детям
Дополнительные исследования репродуктивной токсичности с валганцикловиром не проводились из-за быстрого и полного преобразования валганцикловира в ганцикловир. Ганцикловир нарушает фертильность и оказывает тератогенное действие у животных.
Во время лечения препаратом Вальцит® женщинам детородного возраста следует рекомендовать использовать надежные методы контрацепции, мужчинам рекомендуется использовать барьерный метод контрацепции во время лечения и не менее 90 дней после его окончания.
Безопасность применения препарата Вальцит® при беременности у человека не установлена. При беременности назначения препарата Вальцит® следует избегать, за исключением случаев, когда потенциальный положительный эффект лечения для матери оправдывает возможный риск для плода.
Исследований влияния валганцикловира и ганцикловира на пери- и постнатальное развитие не проводилось, при этом нельзя исключить возможность выделения ганцикловира с грудным молоком и развития серьезных побочных реакций у грудного ребенка. Таким образом, решение об отмене препарата или о прекращении грудного вскармливания следует принимать на основании оценки потенциального положительного эффекта лечения для кормящей матери и риска для грудного ребенка.
Применение у детей
Противопоказано: детский возраст до 12 лет.
Побочные действия
Данные клинических исследований
Все нежелательные явления, зарегистрированные в клинических исследованиях Вальцита, раньше наблюдались при лечении ганцикловиром.
Самые частые нежелательные явления, которые встречались при приеме валганцикловира у больных с ЦМВ ретинитом и СПИД: диарея, нейтропения, лихорадка, кандидоз полости рта, головная боль и слабость.
Наиболее частые нежелательные эффекты вне зависимости от их серьезности и связи с приемом препарата у пациентов после трансплантации органов: диарея, тремор, отторжение трансплантата, тошнота, головная боль, отеки нижних конечностей, запор, бессонница, боли в спине, гипертензия, рвота. Большинство из них были слабо или умеренно выражены. Наиболее частыми нежелательными эффектами вне зависимости от серьезности, но связанными с приемом препарата (вероятная или возможная связь) у пациентов после трансплантации солидных органов были: лейкопения, диарея, тошнота, нейтропения.
Нежелательные явления, которые встречались у больных после трансплантации с частотой ≥2% и не были отмечены в группе больных с ЦМВ ретинитом: гипертензия, гиперкреатининемия, гиперкалиемия, нарушение функции печени.
Побочные эффекты, выявленные более чем у 5% пациентов с ЦМВ ретинитом и после трансплантации органов
Со стороны пищеварительной системы: диарея, тошнота, рвота, боли в животе, запор, боли в верхней половине живота, диспепсия, увеличение живота, асцит, нарушение функции печени.
Со стороны организма в целом: лихорадка, слабость, отеки нижних конечностей, периферические отеки, слабость, снижение веса, снижение аппетита, анорексия, кахексия, дегидратация, реакция отторжения трансплантата.
Со стороны системы кроветворения: нейтропения, анемия, тромбоцитопения, лейкопения.
Инфекционные осложнения: кандидоз полости рта.
Со стороны ЦНС и периферической нервной системы: головная боль, бессонница, периферическая невропатия, парестезии, тремор, головокружение, депрессия.
Дерматологические реакции: дерматит, повышенное потоотделение (ночью), зуд, акне.
Со стороны дыхательной системы: одышка, продуктивный кашель, выделения из носа, плевральный выпот, фарингит, назофарингит, синусит, инфекции верхних дыхательных путей, пневмония, пневмоцистная пневмония.
Со стороны органа зрения: отслойка сетчатки, нечеткое зрение.
Со стороны костно-мышечной системы: боли в спине, артралгии, боли в конечностях, судороги в мышцах.
Со стороны мочевыделительной системы: почечная недостаточность, дизурия, инфекции мочевых путей.
Со стороны сердечно-сосудистой системы: артериальная гипертензия, артериальная гипотензия.
Лабораторные показатели: гиперкреатининемия, гиперкалиемия, гипокалиемия, гипомагниемия, гипергликемия, гипофосфатемия, гипокальциемия.
Прочие: в послеоперационном периоде возможны осложнения, боли после операции, инфекционные осложнения послеоперационной раны, усиление дренажа раны, плохое заживление раны.
Далее перечислены серьезные нежелательные явления, связанные с приемом Вальцита, встречающиеся с частотой менее 5%, не упомянутые выше
Со стороны системы кроветворения: панцитопения, угнетение функции костного мозга, апластическая анемия. Тяжелая нейтропения (менее 500 клеток/мкл) встречалась чаще у пациентов при терапии ЦМВ ретинита (16%), чем при назначении у больных после пересадки органов (5%).
Со стороны мочевыделительной системы: снижение клиренса креатинина, гиперкреатининемия. Повышение уровня креатинина отмечалось чаще у пациентов после трансплантации органов по сравнению с больными, получавшими лечение по поводу ЦМВ ретинита. Нарушение функции почек — характерное осложнение у пациентов после трансплантации.
Со стороны свертывающей системы крови: угрожающие жизни кровотечения, возможно связаны с развитием тромбоцитопении.
Со стороны ЦНС и периферической нервной систем: судороги, психические отклонения, галлюцинации, спутанность, ажитация.
Прочие: повышенная чувствительность к валганцикловиру.
Опыт применения ганцикловира
Поскольку Вальцит быстро превращается в ганцикловир, ниже приводятся нежелательные явления, описанные при лечении ганцикловиром и не упоминавшиеся выше.
Со стороны пищеварительной системы: сухость во рту, холангит, дисфагия, отрыжка, эзофагит, недержание кала, метеоризм, гастрит, желудочно-кишечные расстройства, желудочно-кишечное кровотечение, язвенный стоматит, панкреатит, глоссит, гепатит, желтуха.
Со стороны организма в целом: бактериальные, грибковые и вирусные инфекции, недомогание, мукозит, дрожь, сепсис.
Дерматологические реакции алопеция, эксфолиативный дерматит, реакции фотосенсибилизации, сухость кожи, потливость, крапивница.
Со стороны ЦНС и периферической нервной системы: астения, мигрень, кошмарные сновидения, амнезия, тревога, атаксия, кома, эмоциональные расстройства, гиперкинезы, гипертонус, снижение либидо, миоклонические подергивания, нервозность, сонливость, нарушения интеллекта.
Со стороны костно-мышечной системы: боли в костях и мышцах, миастенический синдром.
Со стороны мочеполовой системы: гематурия, импотенция, частое мочеиспускание.
Лабораторные показатели: повышение активности ЩФ, КФК, ЛДГ в крови, снижение уровня глюкозы в крови, гипопротеинемия.
Со стороны органов чувств: амблиопия, слепота, боли в ухе, кровоизлияния в глаз, боли в глазных яблоках, глухота, глаукома, нарушения вкусового восприятия, несистемное головокружение, изменения в стекловидном теле.
Со стороны системы кроветворения: эозинофилия, лейкоцитоз, лимфоаденопатия, спленомегалия, кровотечения.
Со стороны сердечно-сосудистой системы: аритмии (в т.ч. желудочковые), тромбофлебит глубоких вен, флебит, тахикардия, вазодилатация.
Со стороны дыхательной системы: застойные явления в придаточных пазухах носа.
Со стороны эндокринной системы: сахарный диабет.
Опыт постмаркетингового применения препарата
Ниже приводятся нежелательные явления, описанные в спонтанных сообщениях в ходе пострегистрационного применения ганцикловира, не упомянутые ни в одном из вышеприведенных разделов, для которых нельзя исключить причинную связь с препаратом. Поскольку Вальцит быстро и в большой степени превращается в ганцикловир, эти побочные реакции могут развиться и при лечении Вальцитом: анафилаксия, снижение фертильности у мужчин.
Нежелательные явления, описанные при пострегистрационном применении препарата, аналогичны наблюдавшимся в клинических исследованиях Вальцита и ганцикловира.
Лекарственное взаимодействие
Лекарственные взаимодействия препарата Вальцит®
На модели кишечной проницаемости in situ у крыс взаимодействий валганцикловира с валацикловиром, диданозином, нелфинавиром, циклоспорином, омепразолом и микофенолата мофетилом не обнаружено.
Валганцикловир преобразуется в ганцикловир, поэтому взаимодействия, характерные для ганцикловира, могут ожидаться и при применении препарата Вальцит®.
Лекарственные взаимодействия ганцикловира
Степень связывания ганцикловира с белками плазмы составляет лишь 1-2%, поэтому реакций, связанных с замещением белкового связывания, не ожидается.
Имипенем/циластатин: при одновременном применении ганцикловира и имипенема/ циластатина у больных отмечались судороги. Следует избегать одновременного применения валганцикловира и имипенема/циластатина в случаях, если потенциальные преимущества лечения не превышают возможный риск.
Пробенецид: одновременный пероральный прием пробенецида приводил к статистически значимому снижению почечного клиренса ганцикловира (20%) и к увеличению продолжительности его действия (40%). Это объясняется механизмом взаимодействия — конкуренцией за канальцевую почечную экскрецию. Пациенты, принимающие одновременно пробенецид и препарат Вальцит®, должны находиться под тщательным наблюдением из-за возможного токсического действия ганцикловира.
Зидовудин: при одновременном применении с пероральным ганцикловиром отмечалось небольшое, но статистически значимое увеличение АUC зидовудина (17%), кроме того, отмечалась статистически незначимая тенденция к снижению концентрации ганцикловира. Поскольку как зидовудин, так и ганцикловир могут вызывать нейтропению и анемию, у некоторых пациентов может отмечаться непереносимость при одновременном приеме валганцикловира и зидовудина в полных дозах.
Диданозин: было выявлено стойкое увеличение концентрации диданозина в плазме при одновременном применении с ганцикловиром (как при в/в, так и при пероральном способе применения). В случае перорального приема ганцикловира в дозе 3 г и 6 г в сутки отмечалось увеличение AUC диданозина на 84-124%, при в/в введении ганцикловира в дозах 5-10 мг/кг/сутки AUC диданозина увеличивалась на 38-67%. Это повышение нельзя объяснить конкурентным взаимодействием за почечную канальцевую экскрецию, поскольку процент выведения диданозина при этом увеличивался. Причинами данного увеличения могут быть повышение биодоступности или замедление метаболизма. Клинически значимого влияния на концентрации ганцикловира не отмечалось. Однако, учитывая повышение плазменных концентраций диданозина в присутствии ганцикловира, следует тщательно наблюдать больных на предмет возникновения симптомов токсического действия диданозина при применении препарата Вальцит®.
Микофенолата мофетил: на основании результатов исследования по однократному в/в введению рекомендованной дозы ганцикловира и пероральному приему микофенолата мофетила, а также известного влияния нарушения функции почек на фармакокинетику микофенолата мофетила и ганцикловира, можно ожидать, что одновременное применение валганцикловира и микофенолата мофетила, оказывающих конкурентное взаимодействие в процессе канальцевой секреции, приведет к повышению концентрации ганцикловира и фенольного глюкуронида микофеноловой кислоты. Существенного изменения фармакокинетики микофеноловой кислоты не ожидается, поэтому корректировать дозу микофенолата мофетила не требуется. У больных с нарушением функции почек, которые одновременно получают микофенолата мофетил и валганцикловир, необходимо соблюдать рекомендации по коррекции дозы валганцикловира и проводить тщательное наблюдение.
Залцитабин: залцитабин повышал AUC0-8 перорально принимаемого ганцикловира на 13%. Статистически значимых изменений других фармакокинетических параметров не отмечалось. Клинически значимые изменения фармакокинетики залцитабина при одновременном пероральном приеме ганцикловира также выявлены не были, несмотря на незначительное увеличение константы скорости элиминации.
Ставудин: при одновременном пероральном приеме ганцикловира и ставудина статистически значимого фармакокинетического взаимодействия не отмечалось.
Триметоприм: триметоприм статистически значимо на 16.3% уменьшал почечный клиренс ганцикловира, принимаемого перорально, что сопровождалось также статистически значимым снижением скорости терминальной элиминации и соответствующим возрастанием периода полувыведения на 15%. Тем не менее, клиническая значимость этих изменений маловероятна, поскольку AUC0-8 и Сmaxпри этом не изменялись. Единственным статистически значимым изменением фармакокинетических параметров триметоприма при одновременном приеме ганцикловира было увеличение Сmin на 12%. Однако вряд ли это имеет клиническое значение, поэтому коррекции дозы валганцикловира не требуется.
Циклоспорин: при сравнении концентраций циклоспорина перед приемом следующей дозы данных о том, что ганцикловир изменял фармакокинетику циклоспорина, получено не было. Тем не менее, после начала применения ганцикловира отмечалось некоторое повышение максимальной концентрации креатинина в сыворотке крови.
Другие возможные лекарственные взаимодействия: применение ганцикловира одновременно с другими препаратами, оказывающими миелосупрессивный или нефротоксический эффект (например, дапсоном, пентамидином, флуцитозином, винкристином, винбластином, адриамицином, амфотерицином В, нуклеозидными аналогами и гидроксикарбамидом), может усиливать их токсическое действие. Поэтому эти препараты можно применять одновременно с валганцикловиром только в том случае, если ожидаемая польза от проводимого лечения превышает возможный риск.
Дозировка
Во избежание передозировки необходимо строго соблюдать рекомендации по режиму дозирования.
Стандартный режим дозирования
Препарат Вальцит® следует принимать внутрь во время еды. Валганцикловир быстро и в значительной степени метаболизируется с образованием ганцикловира. Биодоступность ганцикловира в случае приема препарата Вальцит® в 10 раз выше, чем в случае перорального приема ганцикловира.
Взрослые
Индукционная терапия ЦМВ-ретинита
У больных с активным ЦМВ-ретинитом рекомендованная доза препарата Вальцит®составляет 900 мг (2 таб. по 450 мг) 2 раза/сут в течение 21 дня. Длительная индукционная терапия повышает риск миелотоксичности.
Поддерживающая терапия ЦМВ-ретинита
После проведения курса индукционной терапии или у больных с неактивным ЦМВ-ретинитом рекомендованная доза составляет 900 мг (2 таб. по 450 мг) 1 раз в сутки. Если течение ретинита ухудшается, курс индукционной терапии можно повторить.
Профилактика ЦМВ-инфекции после трансплантации солидных органов
Больным, перенесшим трансплантацию почки, необходимо начать терапию препаратом Вальцит® в течение первых 10 дней после операции в дозе 900 мг (2 таб. по 450 мг) 1 раз/сут и продолжать терапию по 200-е сутки посттрансплантационного периода.
Больным, перенесшим трансплантацию других солидных органов, необходимо начать терапию препаратом Вальцит® в течение первых 10 дней после операции в дозе 900 мг (2 таб. по 450 мг) 1 раз/сут и продолжать терапию по 100-е сутки посттрансплантационного периода.
Особые указания по дозированию
Больным с почечной недостаточностью необходимо проводить тщательный контроль концентрации креатинина в сыворотке крови или КК. Коррекцию дозы у взрослых пациентов проводят в зависимости от КК, как это показано в таблице, представленной ниже.
У больных с печеночной недостаточностью эффективность и безопасность не установлены.
Больные с тяжелой лейкопенией, нейтропенией, анемией, тромбоцитопенией или панцитопенией
У больных, получавших препарат Вальцит® (и ганцикловир), отмечались случаи тяжелой лейкопении, нейтропении, анемии, тромбоцитопении, панцитопении, угнетения костного мозга и апластической анемии. Лечение не следует начинать, если абсолютное число нейтрофилов меньше 500 клеток в 1 мкл или число тромбоцитов меньше 25 000 клеток в 1 мкл, а также в случае, если гемоглобин ниже 80 г/л.
У больных пожилого возраста эффективность и безопасность не установлены.
Таблетки препарата Вальцит® не рекомендуются для применения у детей до 18 лет, т.к. эффективность и безопасность применения препарата Вальцит® у данной возрастной группы в соответствующих контролируемых клинических исследованиях не установлена.
Передозировка
У одного взрослого пациента при применении валганцикловира в течение нескольких дней в дозах не менее чем 10-кратно превышающих рекомендованные с учетом нарушения функции почек (снижение КК) развилось угнетение костного мозга (медуллярная аплазия) с летальным исходом.
Возможно, что передозировка валганцикловира может привести к увеличению нефротоксичности.
Снизить концентрации валганцикловира в плазме у пациентов с передозировкой можно путем гемодиализа и гидратации.
Передозировка ганцикловира при в/в введении
Поскольку валганцикловир быстро и в значительной степени преобразуется в ганцикловир, нежелательные явления, наблюдаемые при передозировке ганцикловира, могут быть ожидаемыми и при передозировке препарата Вальцит®.
В ходе клинических исследований и постмаркетингового применения препарата были описаны случаи передозировки ганцикловира при в/в введении. Некоторые из них не сопровождались нежелательными явлениями. У большинства же пациентов отмечалось одно или несколько из следующих нежелательных явлений:
- гематотоксичность: панцитопения, угнетение функции костного мозга, медуллярная аплазия, лейкопения, нейтропения, гранулоцитопения,
- гепатотоксичность: гепатит, нарушение функции печени,
- нефротоксичность: усиление гематурии у больных с уже имеющимся нарушением функции почек, острая почечная недостаточность, повышение концентрации креатинина в сыворотке крови,
- нейротоксичность: генерализованный тремор, судороги.
Меры предосторожности
В экспериментах на животных было выявлено мутагенное, тератогенное, асперматогенное и канцерогенное действие ганцикловира. Препарат Вальцит®следует считать потенциальным тератогеном и канцерогеном для человека, применение которого может вызывать врожденные пороки развития и рак. Кроме того, вероятно, что препарат Вальцит® может временно или необратимо подавлять сперматогенез.
У больных, получающих препарат Вальцит® (и ганцикловир), отмечались случаи тяжелой лейкопении, нейтропении, анемии, тромбоцитопении, панцитопении, угнетения функции костного мозга и апластической анемии. Лечение не следует начинать, если абсолютное число нейтрофилов меньше 500 клеток в 1 мкл или число тромбоцитов меньше 25 000 клеток в 1 мкл, а также в случае, если гемоглобин ниже 80 г/л.
В ходе лечения рекомендуется регулярно проводить контроль развернутой формулы крови и тромбоцитов. Больным с тяжелой лейкопенией, нейтропенией, анемией и/или тромбоцитопенией рекомендуется назначать гемопоэтические факторы роста и/или прерывать прием препарата.
При одновременном применении ганцикловира и имипенема/циластатина у больных отмечались судороги. Следует избегать одновременного применения валганцикловира и имипенема/циластатина в случаях, если потенциальные преимущества лечения не превышают возможный риск.
Поскольку как зидовудин, так и ганцикловир могут вызывать нейтропению и анемию, у некоторых пациентов может отмечаться непереносимость при одновременном приеме валганцикловира и зидовудина в полных дозах.
В связи с возможным повышением плазменных концентраций диданозина в присутствии ганцикловира, следует тщательно наблюдать больных на предмет возникновения симптомов токсического действия диданозина.
Применение препарата Вальцит® одновременно с другими препаратами, оказывающими миелосупрессивный или нефротоксический эффект, может усиливать их токсическое действие.
Биодоступность ганцикловира из препарата Вальцит® в 10 раз превышает таковую капсул ганцикловира. Ганцикловир нельзя заменять на препарат Вальцит® в соотношении 1:1. Больных, которых переводят с капсул ганцикловира, следует информировать о риске передозировки, если они будут принимать большее число таблеток препарата Вальцит®, чем рекомендовано.
Правила обращения с препаратом
Таблетки нельзя разламывать или размельчать. Поскольку препарат Вальцит®потенциально тератогенен и канцерогенен для человека, необходимо соблюдать осторожность, если таблетка разломилась. Следует избегать прямого контакта разломившейся или размельченной таблетки с кожей и слизистыми оболочками. В случаях такого контакта нужно тщательно промыть это место водой с мылом, при попадании в глаза — их тщательно промывают стерильной водой, а при ее отсутствии — простой водой.
Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Влияние на способность к вождению автотранспорта и управлению механизмами
При лечении препаратом Вальцит® и/или ганцикловиром возможно возникновение судорог, седации, головокружения, атаксии и/или спутанности сознания, что может отрицательно повлиять на деятельность, требующую повышенной концентрации внимания, включая управление транспортными средствами и работу с машинами и механизмами. В связи с этим в период лечения препаратом Вальцит® следует соблюдать осторожность при управлении транспортными средствами и работе с машинами и механизмами. При появлении описанных нежелательных явлений следует воздержаться от выполнения указанных видов деятельности.